МЕХАНИЗМЫ НИЗКОУРОВНЕВОЙ СВЕТЛОЙ ТЕРАПИИ
Перевод статьи - MECHANISMS OF LOW LEVEL LIGHT THERAPY
Автор(ы) - Майкл Р. Хамблин (Michael R. Hamblin)
Источник оригинальной статьи:
Майкл Р. Хамблин
Кафедра дерматологии, Гарвардская медицинская школа, BAR 414
Wellman Центр фотомедицины, Массачусетская больница общего профиля
Улица Блоссом 40, Бостон, Массачусетс 02114
[email protected]
www.mgh.harvard.edu/wellman/people/mhamblin.asp
Использование низких уровней видимого или ближнего инфракрасного (NIR) света для уменьшения боли, воспаления и отеков, содействия заживлению ран, более глубоких тканей и нервов и предотвращения повреждения тканей известно уже почти сорок лет с момента изобретения лазеров. Первоначально считавшийся своеобразным свойством лазерного света (мягких или холодных лазеров), субъект теперь расширился, включив фотобиомодуляцию и фотобиостимуляцию с использованием некогерентного света.Несмотря на многочисленные сообщения о положительных результатах экспериментов, проведенных in vitro, на животных моделях и в рандомизированных контролируемых клинических испытаниях, LLLT остается спорным. Это, вероятно, связано с двумя основными причинами; во-первых, биохимические механизмы, лежащие в основе положительных эффектов, не полностью поняты, и, во-вторых, сложность рационального выбора среди большого количества параметров освещения, таких как длина волны, плотность потока, плотность мощности, структура импульса и время обработки, привела к публикации ряда негативных исследований, а также многие позитивные. В частности, часто наблюдается двухфазная реакция на дозу, когда низкие уровни света оказывают гораздо лучший эффект, чем более высокие уровни.
В этом вводном обзоре будут рассмотрены некоторые из предложенных клеточных хромофоров, ответственных за воздействие видимого света на клетки млекопитающих, включая цитохром с оксидазу (с пиками поглощения в NIR) и фотоактивные порфирины.Считается, что митохондрии являются вероятным местом первоначального воздействия света, что приводит к увеличению продукции АТФ, модуляции активных форм кислорода и индукции факторов транскрипции. Эти эффекты, в свою очередь, приводят к увеличению пролиферации и миграции клеток (особенно фибробластами), модуляции уровней цитокинов, факторов роста и медиаторов воспаления, а также повышению оксигенации тканей.Результаты этих биохимических и клеточных изменений у животных и пациентов включают такие преимущества, как усиление заживления хронических ран, улучшение спортивных травм и синдрома запястного канала, уменьшение боли при артрите и невропатиях, а также уменьшение повреждений после сердечных приступов, инсульта, повреждения нерва и токсичность сетчатки.
1. ИСТОРИЯ
В 1967 году, спустя несколько лет после изобретения первого работающего лазера, Endre Mester из Университета Земмельвайс, Будапешт, Венгрия, хотел проверить, может ли лазерное излучение вызывать рак у мышей [1]. Он побрил дорсальные волосы, разделил их на две группы и дал лазерную терапию рубиновым лазером малой мощности (694 нм) одной группе. Они не заболели раком, и, к его удивлению, волосы на обработанной группе отрастали быстрее, чем на необработанной. Это была первая демонстрация «лазерной биостимуляции». С тех пор лечение с использованием источников когерентного света (лазеров) или некогерентного света (светодиодов, светодиодов) прошло через детство и юность. В настоящее время лазерная (или световая) терапия низкого уровня (LLLT), также известная как «холодный лазер», «мягкий лазер», «биостимуляция» или «фотобиомодуляция», практикуется как часть физической терапии во многих частях мира. Фактически, светотерапия является одним из старейших терапевтических методов, используемых людьми (исторически как солнечная терапия египтянами, позже как ультрафиолетовая терапия, за которую Нильс Финсен получил Нобелевскую премию в 1904 году [2]). Использование лазеров и светодиодов в качестве источников света стало следующим шагом в технологическом развитии светотерапии, которое теперь ежедневно применяется ко многим тысячам людей во всем мире. В LLLT вопрос больше не в том, оказывает ли свет биологические эффекты, а в том, как энергия терапевтических лазеров и светодиодов работает на клеточном уровне и на уровне организма, и каковы оптимальные параметры света для различного использования этих источников света.
Одним из важных моментов, который был продемонстрирован многочисленными исследованиями на клеточной культуре [3], на моделях на животных [4] и в клинических исследованиях, является концепция двухфазной реакции на дозу, когда результат сравнивается с общей плотностью доставленной световой энергии (флюенс). Было обнаружено, что существует оптимальная доза света для любого конкретного применения, и дозы, меньшие, чем это оптимальное значение, или, что более важно, больше, чем оптимальное значение, будут иметь уменьшенный терапевтический результат, или для больших доз света отрицательный результат. может даже привести. Имеющиеся данные свидетельствуют о том, что плотность энергии и плотность мощности являются ключевыми биологическими параметрами для эффективности лазерной терапии, и они могут работать как с пороговыми значениями (т. Е. С нижним и верхним порогом для обоих параметров, между которыми лазерная терапия эффективна, и вне которых лазерная терапия слишком слаба, чтобы оказывать какое-либо влияние, или настолько интенсивна, что ткани подавляются) [5].
Причина, по которой методика называется LOW-level, заключается в том, что оптимальные уровни удельной плотности энергии являются низкими по сравнению с другими видами лазерной терапии, применяемыми для абляции, разрезания и термической коагуляции тканей. Как правило, плотности мощности, используемые для LLLT, ниже, чем те, которые необходимы для нагревания ткани, то есть менее 100 мВт / см 2 , в зависимости от длины волны и типа ткани.
2. ФИЗИЧЕСКИЕ МЕХАНИЗМЫ
Согласно квантово-механической теории, световая энергия состоит из фотонов или дискретных пакетов электромагнитной энергии. Энергия отдельного фотона зависит только от длины волны. Следовательно, энергия «дозы» света зависит только от количества фотонов и от их длины волны или цвета (у голубых фотонов больше энергии, чем у зеленых фотонов, у которых больше энергии, чем у красного, у которых больше энергии, чем у NIR и т. Д.) , Фотоны, которые попадают в живую ткань, могут либо поглощаться, либо рассеиваться. Рассеянные фотоны в конечном итоге будут поглощаться или выходить из ткани в форме диффузного отражения.Поглощенные фотоны взаимодействуют с органической молекулой или хромофором, расположенным в ткани. Поскольку эти фотоны имеют длины волн в красной или ближней инфракрасной областях спектра, хромофоры, которые поглощают эти фотоны, имеют тенденцию иметь делокализованные электроны на молекулярных орбиталях, которые могут быть возбуждены из основного состояния в первое возбужденное состояние квантом энергии, передаваемой фотон. Согласно первому закону термодинамики, энергия, доставляемая в ткань, должна быть сохранена, и существуют три возможных пути для объяснения того, что происходит с доставленной световой энергией, когда лазерная терапия низкого уровня доставляется в ткань.
Самый распространенный путь, который происходит, когда свет поглощается живой тканью, называется внутренним преобразованием. Это происходит, когда первое возбужденное синглетное состояние хромофора претерпевает переход из более высокого в более низкое электронное состояние. Это иногда называют «безызлучательной де-возбуждением», потому что фотоны не испускаются. Он отличается от межсистемного скрещивания тем, что, хотя оба являются безызлучательными методами снятия возбуждения, спиновое состояние молекулы для внутреннего превращения остается тем же, в то время как оно изменяется для межсистемного скрещивания. Энергия электронно-возбужденного состояния передается колебательным модам молекулы, иными словами, энергия возбуждения преобразуется в тепло.
Второй путь, который может возникнуть - это флуоресценция.Флуоресценция - это свечение или переизлучение света, при котором молекулярное поглощение фотона запускает излучение другого фотона с большей длиной волны. Разница в энергии между поглощенными и испущенными фотонами заканчивается молекулярными колебаниями или теплом. Длины волн зависят от кривой поглощения и стоксова сдвига конкретного флуорофора.
Третий путь, который может происходить после поглощения света хромофором ткани, представляет собой ряд процессов, широко сгруппированных под зонтичной категорией фотохимии. Из-за энергии вовлеченных фотонов ковалентные связи не могут быть разорваны. Однако энергии достаточно для образования первого возбужденного синглетного состояния, и это может подвергнуться межсистемному переходу в долгоживущее триплетное состояние хромофора. Долгая жизнь этого вида позволяет происходить реакциям, таким как передача энергии молекулярному кислороду (триплету) в основное состояние с образованием реакционноспособных частиц, синглетного кислорода.Альтернативно, триплетное состояние хромофора может подвергаться переносу электрона (возможно, восстановлению) с образованием анион-радикала, который затем может переносить электрон в кислород с образованием супероксида. Реакции переноса электрона очень важны в дыхательной цепи митохондрий, где, как полагают, находятся основные хромофоры, участвующие в лазерной терапии.Третий путь фотохимии, который может происходить после поглощения красного или NIR-фотона, - это диссоциация нековалентно связанного лиганда от сайта связывания на металлсодержащем кофакторе в ферменте. Наиболее вероятным кандидатом на этот путь является связывание оксида азота с железосодержащими и медьсодержащими окислительно-восстановительными центрами в блоке IV дыхательной цепи митохондрий, известной как цитохром с оксидаза (см. Ниже).
Следует отметить, что существует другой механизм, который был предложен для учета низкого уровня лазерного воздействия на ткани. Это объяснение опирается на явление лазерного спекла, характерное для лазерного излучения. Спекл-эффект является результатом интерференции многих волн, имеющих разные фазы, которые складываются вместе, образуя результирующую волну, амплитуда и, следовательно, интенсивность которой изменяются случайным образом. Каждая точка на освещенной ткани действует как источник вторичных сферических волн. Свет в любой точке поля рассеянного света состоит из волн, рассеянных от каждой точки освещаемой поверхности. Если поверхность достаточно шероховата, чтобы создать различия в длине пути, превышающие одну длину волны, вызывая изменения фазы больше, чем 2
 амплитуда (и, следовательно, интенсивность) результирующего света изменяется случайным образом. Предполагается, что изменение интенсивности между спекл-пятнами, расположенными на расстоянии около 1 микрона, может привести к небольшим, но крутым градиентам температуры внутри субклеточных органелл, таких как митохондрии, без возникновения фотохимии. Предполагается, что эти температурные градиенты вызывают некоторые неуточненные изменения в митохондриальном метаболизме.
амплитуда (и, следовательно, интенсивность) результирующего света изменяется случайным образом. Предполагается, что изменение интенсивности между спекл-пятнами, расположенными на расстоянии около 1 микрона, может привести к небольшим, но крутым градиентам температуры внутри субклеточных органелл, таких как митохондрии, без возникновения фотохимии. Предполагается, что эти температурные градиенты вызывают некоторые неуточненные изменения в митохондриальном метаболизме. 3. БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ
Возможно, есть три основные области медицины и ветеринарной практики, где LLT играет важную роль (Рисунок 1). Это (i) заживление ран, восстановление тканей и предотвращение гибели тканей; (ii) облегчение воспаления при хронических заболеваниях и травмах с сопутствующими ему болью и отеком; (iii) облегчение нейрогенной боли и некоторые неврологические проблемы.Предлагаемые пути объяснения механизмов LLLT в идеале должны быть применимы ко всем этим условиям.
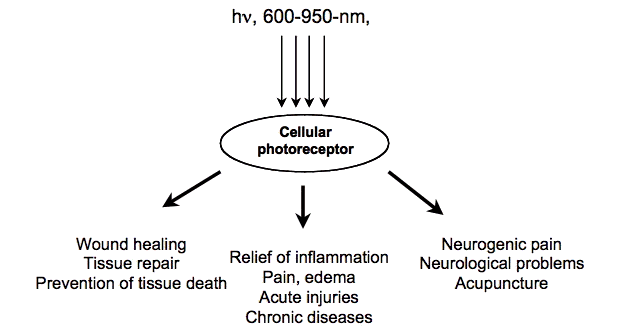
Рисунок 1. Схематическое изображение основных областей применения НИЗ.
3.1 Тканевая фотобиология. Первый закон фотобиологии гласит, что для того, чтобы маломощный видимый свет оказывал какое-либо влияние на живую биологическую систему, фотоны должны поглощаться электронными полосами поглощения, принадлежащими некоторому молекулярному хромофору или фотоакцептору [6]. Одним из подходов к определению идентичности этого хромофора является проведение спектров действия. Это график, представляющий биологический фотоответ как функцию длины волны, волнового числа, частоты или энергии фотона, и он должен напоминать спектр поглощения молекулы фотоакцептора. Тот факт, что структурированный спектр действия может быть сконструирован, подтверждает гипотезу о существовании клеточных фотоакцепторов и сигнальных путей, стимулируемых светом.
Второе важное соображение касается оптических свойств ткани. Как поглощение, так и рассеяние света в ткани зависят от длины волны (оба значительно выше в синей области спектра, чем в красном), а основной хромофор ткани (гемоглобин) имеет высокие полосы поглощения на длинах волн короче 600 нм. По этим причинам существует так называемое «оптическое окно». Второе важное соображение касается оптических свойств ткани. Как поглощение, так и рассеяние света в ткани зависят от длины волны (оба значительно выше в синей области спектра, чем в красном), и основные хромофоры ткани (гемоглобин и меланин) имеют высокие полосы поглощения на длинах волн короче 600 нм. Вода начинает значительно поглощать на длинах волн более 1150 нм. По этим причинам в ткани имеется так называемое «оптическое окно», покрывающее красные и ближние инфракрасные волны, где максимальное проникновение света в ткани максимально (рис. 2).Поэтому, хотя синий, зеленый и желтый свет могут оказывать существенное влияние на клетки, растущие в оптически прозрачной культуральной среде, использование LLLT у животных и пациентов почти исключительно включает красный и NIR свет (600-950 нм).
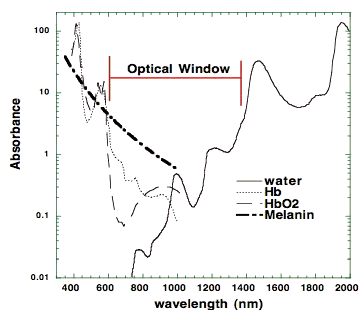
Рисунок 2. Оптическое окно в ткани из-за уменьшенного поглощения красных и NIR длин волн (600-1200 нм) хромофорами ткани.
3.2. Спектры действия. В 1989 году было высказано предположение, что механизм LLLT на клеточном уровне основан на поглощении монохроматического видимого и NIR-излучения компонентами клеточной дыхательной цепи [7]. Внутренняя митохондриальная мембрана содержит 5 комплексов интегральных мембранных белков: NADH-дегидрогеназу (комплекс I), сукцинатдегидрогеназу (комплекс II), цитохром с редуктазу (комплекс III), цитохром с оксидазу (комплекс IV), АТФ-синтазу (комплекс V) и две свободно диффундирующие молекулы, убихинон и цитохром с, которые переносят электроны из одного комплекса в другой (рис. 3). Дыхательная цепь осуществляет поэтапный перенос электронов из NADH и FADH 2 (производимых в цикле лимонной кислоты или Кребса) в молекулы кислорода с образованием (с помощью протонов) молекул воды, использующих энергию, выделяемую в результате этого переноса, для накачки протонов (H +) от матрицы к межмембранному пространству. Градиент протонов, образующихся через внутреннюю мембрану в результате этого активного транспорта, образует миниатюрную батарею. Протоны могут течь обратно вниз по этому градиенту, повторно входя в матрицу, только через другой комплекс интегральных белков во внутренней мембране, комплекс АТФ-синтазы.
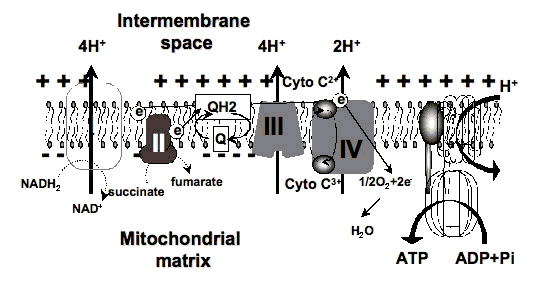
Рисунок 3. Структура митохондриальной дыхательной цепи.
Спектры поглощения, полученные для цитохром с оксидазы в различных степенях окисления, были зарегистрированы и оказались очень похожими на спектры действия для биологических реакций на свет. Поэтому было высказано предположение, что цитохром с оксидаза (Cox) является основным фотоакцептором для диапазона красного NIR в клетках млекопитающих [8] (рис. 4). Единственная наиболее важная молекула в клетках и тканях, которая поглощает свет в диапазоне от 630 до 900 нм, - это Кокс (ответственный за более чем 50% поглощения, превышающего 800 нм. Цитохром С оксидаза содержит два центра железа, гем А и гем 3 (также называемые цитохромами А и А 3 ) и двумя медными центрами, CuA и CuB [9]. Полностью окисленная цитохром с оксидаза имеет оба атома железа в степени окисления Fe (III) и оба атома меди в окислении Cu (II) состояние, в то время как полностью восстановленная цитохром с оксидаза содержит железо в состояниях окисления Fe (II) и меди в Cu (I). Существует много промежуточных смешанных валентных форм фермента и других координатных лигандов, таких как CO, CN и формиат. быть вовлеченным. Все многие индивидуальные степени окисления фермента имеют разные спектры поглощения [10], таким образом, вероятно, объясняются незначительные различия в спектрах действия LLLT, о которых сообщалось. Недавняя работа группы Кару [11] дала следующие диапазоны длин волн для четырех пиков в LСпектр действия LLT: 1) 613,5-623,5 нм, 2) 667,5-683,7 нм, 3) 750,7-772,3 нм, 4) 812,5-846,0 нм.
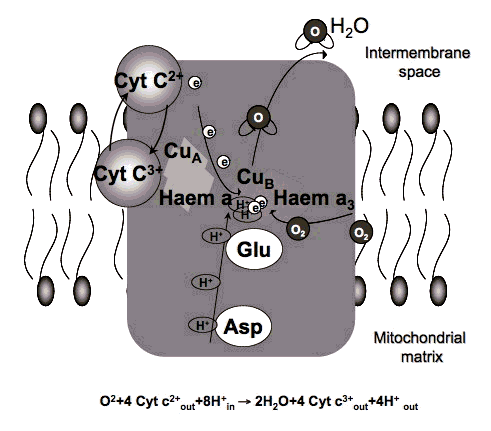
Рисунок 4. Структура и механизм действия цитохром с оксидазы.
Исследование Pastore et al. [12] исследовали влияние He-Ne-лазера (632,8 нм) на очищенный фермент оксидазу цитохрома с и обнаружили повышенное окисление цитохрома с и увеличение переноса электронов. Артюхов с коллегами обнаружили [13] повышенную ферментативную активность каталазы после He-Ne лазерного освещения.
Поглощение фотонов молекулами приводит к электронно-возбужденным состояниям и, следовательно, может привести к ускорению реакций переноса электронов [14]. Увеличение переноса электронов обязательно приводит к увеличению продукции АТФ [15].Индуцированное светом увеличение синтеза АТФ и увеличение протонного градиента приводит к увеличению активности антипортеров Na + / H + и Ca 2+ / Na + и всех ATP-управляемых носителей для ионов, таких как Na + / K + ATPase и Ca 2+ насосы. АТФ является субстратом для аденилциклазы, и, следовательно, уровень АТФ контролирует уровень цАМФ. Ca 2+ и cAMP являются очень важными вторичными мессенджерами. Ca 2+ регулирует практически все процессы в организме человека (сокращение мышц, свертывание крови, передача сигналов в нервах, экспрессия генов и т. Д.).
3.3. Оксид азота и НИЗ. Опосредованная светом вазодилатация была впервые описана в 1968 году Фурчготтом в его исследовании оксида азота, которое привело к получению Нобелевской премии тридцать лет спустя в 1998 году [16]. Более поздние исследования, проведенные другими исследователями, подтвердили и расширили раннюю работу Фурчготта и продемонстрировали способность света влиять на локализованное производство или высвобождение NO, а также стимулировать вазодилатацию посредством воздействия NO на цГМФ. Этот вывод свидетельствует о том, что правильно спроектированные устройства освещения могут быть эффективными неинвазивными терапевтическими средствами для пациентов, которые выиграли бы от увеличения локальной доступности NO. Тем не менее, длины волн, которые являются наиболее эффективными при этом опосредованном светом высвобождении NO, отличаются от тех, которые используются в LLLT, и находятся в УФ-A (320-400 нм) и синем диапазоне [17].
Некоторые длины волны света поглощаются гемоглобином, и это освещение может высвобождать NO из гемоглобина (в частности, из нитрозотиолов в бета-цепи молекулы гемоглобина) в эритроцитах (RBC) [18-20], поскольку эритроциты постоянно доставляются в В области лечения существует естественный запас NO, который может выделяться из каждого нового эритроцита, который проходит под источником света и подвергается воздействию соответствующей длины волны фотоэнергии. Поскольку период полураспада NO, выделяющегося под зоной освещения, составляет всего 2-3 секунды, выброс NO очень локальный, что предотвращает проявление эффекта увеличения NO в других частях тела. Вазодилатация из NO основана на его влиянии на фермент гуанилатциклазу (GC), которая образует цГМФ для фосфорилирования миозина и расслабления гладкомышечных клеток в сосудистой системе. Как только доступные уровни GC будут насыщены NO, или когда будут достигнуты максимальные уровни cGMP, дальнейшее расширение сосудов за счет освещения не произойдет, пока эти биологические соединения не вернутся к своему состоянию до освещения. Опять же, длины волн, которые, как было показано, опосредуют этот эффект, как правило, находятся в диапазонах UV-A и синего, а не в диапазонах длин волн красного и NIR, которые в основном используются для LLLT [21].
Активность цитохром с оксидазы ингибируется оксидом азота (NO) [22, 23]. Это удивительное открытие о том, что организм может отравить один из своих собственных ферментов, первоначально было проигнорировано как несовершенство [24], но несколько лет спустя несколько групп сообщили, что митохондрии продуцировали фермент, который синтезирует NO [25], который был идентифицирован как нейрональные изоформы NO-синтазы [26].Было предположено, что эволюционно созданная цитохром с оксидаза связывает не только кислород, но и NO. Эффект замедления дыхания в некоторых местах состоял в том, чтобы отводить кислород в других местах в клетках и тканях, например, NO блокирует дыхание в клетках эндотелия, выстилающих кровеносные сосуды, и это помогает переносить кислород в клетки гладких мышц в этих сосудах [27].
Это ингибирование митохондриального дыхания NO может быть объяснено прямой конкуренцией между NO и O 2 за восстановленный двухъядерный центр CuB / a3 цитохром с оксидазы и является обратимым [28]. Было высказано предположение, что лазерное облучение может обратить вспять ингибирование цитохром с оксидазы NO путем фотодиссоциации NO от его сайтов связывания [24, 29]. Поскольку это координатное связывание намного слабее, чем ковалентная связь, эта диссоциация возможна с помощью видимого и ближнего инфракрасного света, у которого недостаточно энергии для разрыва ковалентных связей. Таким образом, диссоциация NO от Кокса увеличивает частоту дыхания («гипотеза NO») [29]. Свет действительно может обратить вспять ингибирование, вызванное связыванием NO с цитохромоксидазой, как в изолированных митохондриях, так и в целых клетках [30]. Свет может также защитить клетки от NO-индуцированной гибели клеток.В этих экспериментах использовался свет в видимом спектре с длинами волн от 600 до 630 нм. NIR также, по-видимому, оказывает влияние на цитохромоксидазу в условиях, где вероятность присутствия NO отсутствует.
Тиина Кару предоставила экспериментальные доказательства [29], что NO участвует в механизме клеточного ответа на LLLT в красной области спектра. Суспензию клеток HeLa облучали 600-860 нм или диодным лазером при 820 нм, и после 30-минутной инкубации подсчитывали количество клеток, прикрепленных к стеклянной матрице. Доноры NO, нитропруссид натрия (SNP), тринитрат глицерина (GTN) или нитрит натрия (NaNO 2 ), добавляли в клеточную суспензию до или после облучения. Обработка клеточной суспензии SNP перед облучением значительно модифицирует спектр действия для усиления свойства прикрепления клеток и устраняет вызванное светом увеличение числа клеток, прикрепленных к стеклянной матрице, предположительно, путем связывания NO с цитохром с оксидазой. , Другие исследования in vivo по использованию света 780 нм для стимуляции заживления костей у крыс [31], использование лазера 804 нм для уменьшения повреждений, нанесенных сердцам крыс после возникновения сердечных приступов [32], показали значительное увеличение NO в ткани после LLLT с подсветкой. С другой стороны, сообщалось об исследованиях по применению красного и NIR LLLT для лечения мышей с артритом, вызванным внутрисуставной инъекцией зимозана [33], а также с использованием лазера с длиной волны 660 нм для инсультов, созданных у крыс [34]. оба показали снижение NO в тканях. Эти авторы объяснили это наблюдение, предположив, что LLLT ингибирует индуцибельную синтазу оксида азота (iNOS).
В дополнение к опосредованному цитохромом оксидазой увеличению продукции АТФ, в LLLT могут действовать и другие механизмы.Первая из них, которую мы рассмотрим, это «гипотеза синглетного кислорода». Некоторые молекулы с видимыми полосами поглощения, такие как порфирины, в которых отсутствуют координационные центры переходных металлов [35], и некоторые флавопротеины [36], могут превращаться в долгоживущее триплетное состояние после поглощения фотонов. Это триплетное состояние может взаимодействовать с основным кислородом с передачей энергии, приводящей к образованию реактивных частиц, синглетного кислорода. Это та же молекула, которая используется в фотодинамической терапии (ФДТ) для уничтожения раковых клеток, разрушения кровеносных сосудов и уничтожения микробов.Исследователи в ФДТ давно знают, что очень низкие дозы ФДТ могут вызывать пролиферацию клеток и стимуляцию тканей вместо гибели, наблюдаемой при высоких дозах [37].
Следующим предложенным механизмом была «гипотеза изменения окислительно-восстановительных свойств» [38]. Изменение митохондриального метаболизма и активация дыхательной цепи при освещении также увеличат выработку супероксидных анионов, O 2 .- .Было показано, что общая клеточная продукция O 2 .- зависит главным образом от метаболического состояния митохондрий. Другие окислительно-восстановительные цепи в клетках также могут быть активированы с помощью LLLT. NADPH-оксидаза является ферментом, обнаруживаемым в активированных нейтрофилах, способным к немитохондриальному респираторному взрыву, и может индуцироваться выработка большого количества АФК [39]. Эти эффекты зависят от физиологического статуса организма хозяина, а также от радиационных параметров.
3.4 Сотовая сигнализация. Комбинация продуктов восстановительного потенциала и восстановительной способности связанных окислительно-восстановительных пар, присутствующих в клетках и тканях, представляет собой окислительно-восстановительную среду (окислительно-восстановительное состояние) клетки. Редокс-пары, присутствующие в клетке, включают: никотинамид-аденин-динуклеотид (окисленные / восстановленные формы) NAD / NADH, никотинамид-аденин-динуклеотид-фосфат NADP / NADPH, глутатион / глутатион-дисульфидную пару GSH / GSSG и пару тиоредоксин / тиоредоксин-дисульфид TrxSS [40]. Несколько важных путей регуляции опосредованы через окислительно-восстановительное состояние клеток. Изменения в окислительно-восстановительном состоянии вызывают активацию многочисленных внутриклеточных сигнальных путей, регулируют синтез нуклеиновых кислот, синтез белка, активацию ферментов и прогрессирование клеточного цикла [41].Эти цитозольные ответы, в свою очередь, вызывают транскрипционные изменения. Некоторые факторы транскрипции регулируются изменениями в окислительно-восстановительном состоянии клеток. Среди них окислительно-восстановительный фактор-1 (Ref-1) -зависимый активатор белка-1 (AP-1) (Fos и Jun), ядерный фактор (B (NF- (B), p53), активирующий фактор транскрипции / цАМФ-ответный элемент- связывающий белок (ATF / CREB), гипоксия-индуцируемый фактор (HIF) -1
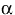 HIF-подобный фактор. Фигура 5 иллюстрирует влияние редокс-чувствительных факторов транскрипции, активированных после LLLT, на индукцию транскрипции защитных генных продуктов. Как правило, окисленные формы редокс-зависимых факторов транскрипции обладают низкой ДНК-связывающей активностью. Ref-1 является важным фактором для специфического снижения этих факторов транскрипции. Однако было также показано, что низкие уровни окислителей, по-видимому, стимулируют пролиферацию и дифференцировку некоторых типов клеток [42-44].
HIF-подобный фактор. Фигура 5 иллюстрирует влияние редокс-чувствительных факторов транскрипции, активированных после LLLT, на индукцию транскрипции защитных генных продуктов. Как правило, окисленные формы редокс-зависимых факторов транскрипции обладают низкой ДНК-связывающей активностью. Ref-1 является важным фактором для специфического снижения этих факторов транскрипции. Однако было также показано, что низкие уровни окислителей, по-видимому, стимулируют пролиферацию и дифференцировку некоторых типов клеток [42-44]. 
Фигура 5. Клеточные сигнальные пути, индуцированные LLLT.
Предполагается, что LLLT вызывает сдвиг общего окислительно-восстановительного потенциала клеток в направлении большего окисления [45]. Различные клетки в различных условиях роста имеют различные окислительно-восстановительные состояния.Следовательно, последствия LLLT могут значительно различаться.Клетки, изначально находящиеся в более восстановленном состоянии (низкий внутриклеточный pH), обладают высоким потенциалом реагировать на LLLT, тогда как клетки в оптимальном окислительно-восстановительном состоянии слабо реагируют или не реагируют на обработку светом.
4. РЕЗУЛЬТАТЫ IN VITRO
4.1 Типы клеток. Существуют доказательства того, что множественные типы клеток млекопитающих и микробов могут отвечать на LLLT. Во многих работах Кару использовались клетки Escherichia coli (грамотрицательные аэробные бактерии) [46] и HeLa [47], а также линия клеток рака шейки матки человека. Однако для валидации клинического применения LLLT гораздо важнее изучить влияние LLLT на незлокачественные типы клеток, которые могут быть полезны для стимулирования некоторых заболеваний или травм. Для исследований типа заживления ран, эти клетки, вероятно, являются эндотелиальными клетками [48], фибробластами [49], кератиноцитами [50] и, возможно, некоторыми классами лейкоцитов.такие как макрофаги [51] и нейтрофилы [52]. В исследованиях по облегчению боли и восстановлению нервов эти клетки будут нейронами [53-55] и глиальными клетками [56]. Для противовоспалительных и противоотечных применений типами клеток будут макрофаги [51], тучные клетки [57], нейтрофилы [58], лимфоциты [59] и т. Д. Имеется литературное доказательство in vitroэффектов LLLT для большинства из этих типов клеток.
4.2 Изолированные митохондрии. Поскольку дыхательная цепь и цитохром с оксидаза находятся в митохондриях, несколько групп исследовали влияние LLLT на препараты изолированных митохондрий. Наиболее популярной системой для изучения является воздействие HeNe-лазера (632,8 нм) на митохондрии, выделенные из печени крысы. Обнаружен повышенный электрохимический потенциал протонов и синтез АТФ [60]. Увеличение синтеза РНК и белка было продемонстрировано после 5 Дж / см 2 [61]. Pastore et al.[62] обнаружили увеличение активности цитохром с оксидазы и увеличение полярографически измеренного поглощения кислорода после 2 Дж / см 2, равного 632,8 нм. Основная стимуляция активности протонной накачки - около 55% увеличения отношения H + / e - было обнаружено в освещенных митохондриях. Yu et al. [14] использовали лазер с длиной волны 660 нм при плотности мощности 10 мВт / см 2 и показали повышенное потребление кислорода (0,6 Дж / см 2 и 1,2 Дж / см 2 ), повышенный потенциал фосфата и заряд энергии (1,8 Дж / см 2 и 2,4 Дж / см 2 ), а также усиление активности NADH, убихинон-оксидоредуктазы, убихинола, феррицитохром-С-оксидоредуктазы и ферроцитохрома С и кислород-оксидоредуктазы (от 0,6 Дж / см 2 до 4,8 Дж / см 2 ).
4.3. LLLT клеточный ответ. Клеточные ответы, наблюдаемые in vitro после LLLT, можно широко классифицировать при увеличении метаболизма, миграции, пролиферации и увеличении синтеза и секреции различных белков. Многие исследования сообщают о влиянии более чем на один из этих параметров. Yu et al. [50] сообщили о культивируемых кератиноцитах и фибробластах, которые облучали HeNe-лазером 0,5-1,5 Дж / см 2 (632,8 нм). Они обнаружили значительное увеличение высвобождения основного фактора роста фибробластов (bFGF) как из кератиноцитов, так и из фибробластов, а также значительное увеличение высвобождения факторов роста нервов из кератиноцитов. Среда из облученных лазером кератиноцитов стимулировала поглощение [3Н] тимидина и пролиферацию культивируемых меланоцитов. Кроме того, миграция меланоцитов усиливалась либо непосредственно HeNe-лазером, либо косвенно средой, полученной из обработанных HeNe-лазером (632,8 нм) кератиноцитов.
Наличие клеточных ответов на LLLT на молекулярном уровне также было продемонстрировано [63]. Нормальные человеческие фибробласты подвергались в течение 3 дней воздействию 0,88 Дж / см 2 света на 628 нм от светоизлучающего диода. Профили экспрессии генов при облучении исследовали с использованием микрочипа кДНК, содержащего 9982 гена человека. Было обнаружено, что 111 генов подвержены воздействию света. Все гены из категории, связанной с антиоксидантами, и гены, связанные с энергетическим обменом и дыхательной цепью, были активированы.Большинство генов, связанных с пролиферацией клеток, также подвергались положительной регуляции. Среди генов, связанных с апоптозом и реакцией на стресс, некоторые гены, такие как JAK-связывающий белок, были активированы, другие, такие как HSP701A, каспаза 6 и вызванный стрессом фосфопротеин, были понижены.Было высказано предположение, что LLLT стимулирует рост клеток напрямую, регулируя экспрессию специфических генов, а также косвенно, регулируя экспрессию генов, связанных с синтезом и репарацией ДНК и метаболизмом клеток.
5. ЖИВОТНЫЕ МОДЕЛИ
Существует большое количество моделей на животных, которые использовались для демонстрации эффектов LLLT на различные заболевания, травмы, а также хронические и острые состояния. В этом обзоре я рассмотрю только три конкретных приложения, для которых имеются хорошие литературные отчеты об эффективности.
5.1 Заживление ран. Литература по LLLT, применяемая для стимуляции заживления ран на различных моделях животных, содержит как положительные, так и отрицательные исследования.Причины противоречивых сообщений, иногда в очень похожих моделях ран, вероятно, разнообразны. Вероятно, что применение LLLT в моделях на животных будет более эффективным, если оно будет выполнено на моделях, которые имеют некоторое внутреннее заболевание. Хотя было несколько сообщений о том, что такие процессы, как заживление ран, ускоряются с помощью LLLT у нормальных грызунов [3, 34], альтернативный подход заключается в том, чтобы ингибировать заживление путем индукции некоторых специфических болезненных состояний. Это было сделано в случае диабета, заболевания, которое, как известно, значительно подавляет заживление ран у пациентов. LLLT значительно улучшает заживление ран как у крыс с диабетом [35, 36], так и у мышей с диабетом [37, 38]. LLLT был также эффективен при заживлении ран у мышей с рентгеновским излучением [39]. Исследование [64] на безволосых мышах показало улучшение прочности на разрыв облученных HeNe лазером (632,8 нм) ран через 1 и 2 недели. Кроме того, общее содержание коллагена значительно увеличилось через 2 месяца по сравнению с контрольными ранами.
Благоприятное влияние LLLT на заживление ран можно объяснить, рассматривая несколько основных биологических механизмов, включая индукцию экспрессии цитокинов и факторов роста, которые, как известно, ответственны за многие фазы заживления ран. Во-первых, есть сообщение [65], что HeNe-лазер (632,8 нм) увеличивал уровни IL-1 как в белке, так и в мРНК.  и IL-8 в кератиноцитах. Это цитокины, ответственные за начальную воспалительную фазу заживления раны. Во-вторых, имеются сообщения [66], что LLLT может активировать цитокины, ответственные за пролиферацию и миграцию фибробластов, такие как bFGF, HGF и SCF. В-третьих, сообщалось [67], что LLLT может увеличивать факторы роста, такие как VEGF, ответственные за неоваскуляризацию, необходимую для заживления ран. В-четвертых, TGF-β является фактором роста, ответственным за индукцию синтеза коллагена из фибробластов, и, как сообщается, активируется LLLT [68]. В-пятых, есть сообщения [69, 70], что LLLT может индуцировать превращение фибробластов в миофиблобласты, тип клеток, которые экспрессируют гладкую мускулатуру.
и IL-8 в кератиноцитах. Это цитокины, ответственные за начальную воспалительную фазу заживления раны. Во-вторых, имеются сообщения [66], что LLLT может активировать цитокины, ответственные за пролиферацию и миграцию фибробластов, такие как bFGF, HGF и SCF. В-третьих, сообщалось [67], что LLLT может увеличивать факторы роста, такие как VEGF, ответственные за неоваскуляризацию, необходимую для заживления ран. В-четвертых, TGF-β является фактором роста, ответственным за индукцию синтеза коллагена из фибробластов, и, как сообщается, активируется LLLT [68]. В-пятых, есть сообщения [69, 70], что LLLT может индуцировать превращение фибробластов в миофиблобласты, тип клеток, которые экспрессируют гладкую мускулатуру.  -актин и десмин, а также имеет фенотип сократительных клеток, которые ускоряют сокращение раны.
-актин и десмин, а также имеет фенотип сократительных клеток, которые ускоряют сокращение раны.
5.2 Нейрональная токсичность. В исследованиях группы Уилана было изучено использование светодиодов с длиной волны 670 нм в борьбе с повреждением нейронов, вызванным нейротоксинами.Метаноловая интоксикация вызвана его метаболическим превращением в муравьиную кислоту, которая вызывает повреждение сетчатки и зрительного нерва, что приводит к слепоте.Используя модель крысы и электроретинограмму в качестве чувствительного индикатора функции сетчатки, они продемонстрировали, что три кратких 670 нм светодиода (4 Дж / см 2), проводимые при 5, 25 и 50 ч отравления метанолом, ослабили ретинотоксические эффекты полученный из метанола формиат.Наблюдалось значительное восстановление функции, опосредованной палочками и колбочками, у крыс, обработанных светодиодами, отравленных метанолом, и гистопатологических доказательств защиты сетчатки [71]. В последующем исследовании [72] изучалось влияние необратимого ингибитора цитохром с оксидазы, цианида калия, на первичные культивируемые нейроны.Обработка светодиодами частично восстановила активность фермента, блокированную 10-100 мкМ KCN. Это значительно уменьшило гибель нейрональных клеток, вызванную 300 мкМ KCN, с 83,6 до 43,5%. LED значительно восстанавливал содержание АТФ в нейронах только при 10 мкМ KCN, но не при более высоких концентрациях KCN. Напротив, светодиод был способен полностью обратить пагубное влияние тетродотоксина, который лишь косвенно снижает уровень ферментов. Среди протестированных длин волн (670, 728, 770, 830 и 880 нм) наиболее эффективные (670 нм и 830 нм) соответствовали спектру поглощения NIR окисленной цитохром с оксидазы.
5.3. Восстановление нервов. Животные модели были использованы для изучения LLLT-эффектов при восстановлении нерва [73, 74]. Бирнес и соавт. [56] использовали 1600 Дж / см 2 810-нм диодного лазера для улучшения заживления и функциональности дорсальной полисекции спинного мозга Т9 у крыс. Андерс и соавт.[75] изучали LLLT для регенерации раздавленных лицевых нервов крысы; сравнив 361, 457, 514, 633, 720 и 1064 нм, и нашел лучший отклик с 162,4 Дж / см 2 633 нм HeNe-лазером.
6. КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Низкоэнергетическая лазерная терапия используется физиотерапевтами для лечения широкого спектра острых и хронических мышечно-скелетных болей и болей, стоматологами для лечения воспаленных тканей полости рта и для лечения различных изъязвлений, дерматологами для лечения отеков, незаживающих язв, ожогов, дерматит - ортопедами для облегчения боли и лечения хронических воспалений и аутоиммунных заболеваний, а также другими специалистами и врачами общей практики. Лазерная терапия также широко используется в ветеринарной медицине (особенно в центрах обучения скаковых лошадей), а также в спортивно-лечебных и реабилитационных клиниках (для уменьшения отека и гематомы, облегчения боли, улучшения подвижности и лечения острых травм мягких тканей). Лазеры и светодиоды применяются непосредственно в соответствующих областях (например, раны, места травм) или в различных точках тела (точки акупунктуры, точки запуска мышц). Тем не менее, одним из наиболее важных ограничений для продвижения области LLLT в основную медицинскую практику является отсутствие должным образом контролируемых и слепых клинических испытаний. Испытания должны быть проспективными, плацебо-контролируемыми и двойными слепыми и содержать достаточное количество субъектов, позволяющих сделать статистически обоснованные выводы.
Клиническое применение маломощной лазерной терапии разнообразно. Область характеризуется различными методологиями и использованием различных источников света (лазеры, светодиоды) с различными параметрами (длина волны, выходная мощность, режимы непрерывной или импульсной работы, параметры импульса). В последние годы более длинные волны (~ 800-900 нм) и более высокие выходные мощности (до 100 мВт) были предпочтительными в терапевтических устройствах, особенно для обеспечения более глубокого проникновения в ткани. В 2002 году MicroLight Corp получила разрешение FDA 510K для диодного лазера ML 830 нм для лечения синдрома запястного канала. Было проведено несколько контролируемых исследований, в которых сообщалось о значительном улучшении боли и некотором улучшении объективных показателей исхода [76-78]. С тех пор несколько источников света были утверждены как эквивалент инфракрасного нагрева лампы для обработки широкого спектра заболеваний опорно-двигательных аппарата, без поддерживающих клинических исследований.
7. Неразрешенные вопросы
7.1 Длина волны. Это, вероятно, тот параметр, по которому в сообществе LLLT существует наибольшее согласие. Длины волн в диапазоне 600-700 нм выбираются для обработки поверхностных тканей, а длины волн от 780 до 950 нм выбираются для более глубоких тканей из-за более длинных оптических расстояний проникновения через ткани. Длины волн от 700 до 770 нм не имеют большой активности. Некоторые устройства комбинируют красную длину волны с длиной волны NIR на том основании, что комбинация двух длин волн может иметь аддитивные эффекты, а также может позволить более широко использовать устройство для лечения большего количества заболеваний. Конечно, предстоит проделать гораздо большую работу, чтобы определить оптимальную длину волны для различных показаний, для которых используется LLLT.
7.2 Лазер против некогерентного света. Одна из наиболее актуальных и широко обсуждаемых проблем в клиническом сообществе LLLT заключается в том, имеют ли когерентность и монохроматическая природа лазерного излучения дополнительные преимущества по сравнению с более широкополосным светом от обычного источника света или светодиода с той же центральной длиной волны и интенсивностью , Следует выделить два аспекта этой проблемы: согласованность самого света и согласованность взаимодействия света с веществом (биомолекулами, тканями).Последнее взаимодействие вызывает явление, известное как лазерное пятнышко, которое, как полагают, играет роль в фотобиомодуляционном взаимодействии с клетками и субклеточными органеллами. Трудно спроектировать эксперимент для прямого сравнения когерентного лазерного излучения с некогерентным не лазерным светом по следующей причине. Лазерный свет почти всегда является монохроматическим с шириной полосы 1 нм или менее, и очень трудно генерировать свет из любого другого источника (даже светодиода), ширина полосы которого уже 10-20 нм, поэтому при наблюдении он будет неопределенным различия связаны с когерентным и некогерентным светом или с монохроматическим и узкополосным светом.
7.3 Доза. Из-за возможного существования двухфазной кривой доза-эффект, упомянутой выше, выбор правильной дозы света (с точки зрения плотности энергии) для любого конкретного медицинского состояния затруднен. Кроме того, в литературе была некоторая путаница в отношении доставляемой энергии, когда световое пятно мало. Если 5 Дж света попадает на пятно 5 мм 2 , флюенс составляет 100 Дж / см 2 , что номинально такое же, как 100 Дж / см 2 придоставке до 10 см 2 , но полная энергия, доставляемая в последнем случае в 200 раз больше. Используемая доза света зависит от патологии, которую лечат, и, в частности, от того, насколько глубоко, по-видимому, свет должен проникнуть в ткань. Дозы, которые часто используются в красных длинах волн при довольно поверхностных заболеваниях, обычно находятся в области 4 Дж / см 2 с диапазоном 1-10 Дж / см 2 . Дозы длин волн NIR, которые обычно используются для более глубоких расстройств, могут быть выше, чем эти значения, то есть в диапазоне 10-50 Дж / см 2 . Световое лечение обычно повторяется каждый день или через день, и курс лечения может длиться около двух недель.
7.4 Импульсный или CW. Было несколько сообщений о том, что структура импульса является важным фактором в LLLT; например, Ueda et al. [79, 80] обнаружили лучшие эффекты при использовании импульсов с частотой 1 или 2 Гц по сравнению с лазером с частотой 8 Гц или CW 830 нм на костных клетках крыс, но основной механизм этого эффекта неясен.
7.5 Поляризационный статус. Есть некоторые утверждения, что поляризованный свет имеет лучшие эффекты в приложениях LLLT, чем идентичный неполяризованный свет (или даже повернутый на 90 градусов поляризованный свет) [81]. Однако известно, что поляризованный свет быстро скремблируется в сильно рассеивающих средах, таких как ткани (вероятно, в первых нескольких сотнях микрон), и поэтому представляется крайне маловероятным, что поляризация может играть роль, за исключением поверхностных применений для верхних слоев кожа.
7.6 Системные эффекты. Хотя LLLT в основном применяется к локализованным заболеваниям, и его воздействие часто считается ограниченным облучаемой областью, имеются сообщения о системных эффектах LLLT, действующих в месте, удаленном от освещения [82, 83]. Хорошо известно, что ультрафиолетовый свет может иметь системные эффекты [84], и было предложено, чтобы красный и ближний инфракрасный свет также могли оказывать системные эффекты. Предполагается, что они опосредуются растворимыми медиаторами, такими как эндорфины и серотонин.Существует целая область, известная как лазерная акупунктура [85], в которой предполагается, что стимуляция определенных точек акупунктуры сфокусированным лазерным лучом имеет эффект, подобный отдаленным, с более известными методами иглоукалывания иглой.
ПРИМЕЧАНИЕ РЕДАКЦИИ (23.02.13)
Следуйте по этой ССЫЛКЕ, чтобы получить список из 3080 статей о LLLT на PubMed.
СПИСОК ЛИТЕРАТУРЫ
[1] E. Mester, B. Szende and P. Gartner, The effect of laser beams on the growth of hair in mice, Radiobiol Radiother (Berl) 9 (1968) 621-6.
[2] R. Roelandts, The history of phototherapy: something new under the sun?, J Am Acad Dermatol 46 (2002) 926-30.
[3] A.N. Pereira, P. Eduardo Cde, E. Matson and M.M. Marques, Effect of low-power laser irradiation on cell growth and procollagen synthesis of cultured fibroblasts, Lasers Surg Med 31 (2002) 263-7.
[4] J.S. Kana, G. Hutschenreiter, D. Haina and W. Waidelich, Effect of low-power density laser radiation on healing of open skin wounds in rats, Arch Surg 116 (1981) 293-6.
[5] A.P. Sommer, A.L. Pinheiro, A.R. Mester, R.P. Franke and H.T. Whelan, Biostimulatory windows in low-intensity laser activation: lasers, scanners, and NASA's light-emitting diode array system, J Clin Laser Med Surg 19 (2001) 29-33.
[6] J.C. Sutherland, Biological effects of polychromatic light, Photochem Photobiol 76 (2002) 164-70.
[7] T. Karu, Laser biostimulation: a photobiological phenomenon, J Photochem Photobiol B 3 (1989) 638-40.
[8] T.I. Karu and N.I. Afanas'eva, Cytochrome c oxidase as the primary photoacceptor upon laser exposure of cultured cells to visible and near IR-range light, Dokl Akad Nauk 342 (1995) 693-5.
[9] R.A. Capaldi, F. Malatesta and V.M. Darley-Usmar, Structure of cytochrome c oxidase, Biochim Biophys Acta 726 (1983) 135-48.
[10] I. Szundi, G.L. Liao and O. Einarsdottir, Near-infrared time-resolved optical absorption studies of the reaction of fully reduced cytochrome c oxidase with dioxygen, Biochemistry 40 (2001) 2332-9.
[11] T.I. Karu and S.F. Kolyakov, Exact action spectra for cellular responses relevant to phototherapy, Photomed Laser Surg 23 (2005) 355-61.
[12] D. Pastore, M. Greco and S. Passarella, Specific helium-neon laser sensitivity of the purified cytochrome c oxidase, Int J Radiat Biol 76 (2000) 863-70.
[13] V.G. Artyukhov, O.V. Basharina, A.A. Pantak and L.S. Sveklo, Effect of helium-neon laser on activity and optical properties of catalase, Bull Exp Biol Med 129 (2000) 537-40.
[14] W. Yu, J.O. Naim, M. McGowan, K. Ippolito and R.J. Lanzafame, Photomodulation of oxidative metabolism and electron chain enzymes in rat liver mitochondria, Photochem Photobiol 66 (1997) 866-71.
[15] S. Passarella, He-Ne laser irradiation of isolated mitochondria, J Photochem Photobiol B 3 (1989) 642-3.
[16] S.J. Ehrreich and R.F. Furchgott, Relaxation of mammalian smooth muscles by visible and ultraviolet radiation, Nature 218 (1968) 682-4.
[17] H. Chaudhry, M. Lynch, K. Schomacker, R. Birngruber, K. Gregory and I. Kochevar, Relaxation of vascular smooth muscle induced by low-power laser radiation, Photochem Photobiol 58 (1993) 661-9.
[18] R. Mittermayr, A. Osipov, C. Piskernik, S. Haindl, P. Dungel, C. Weber, Y.A. Vladimirov, H. Redl and A.V. Kozlov, Blue laser light increases perfusion of a skin flap via release of nitric oxide from hemoglobin, Mol Med 13 (2007) 22-9.
[19] L. Vladimirov, A., G.I. Klebanov, G.G. Borisenko and A.N. Osipov, Molecular and cellular mechanisms of the low intensity laser radiation effect, Biofizika 49 (2004) 339-50.
[20] Y.A. Vladimirov, A.N. Osipov and G.I. Klebanov, Photobiological principles of therapeutic applications of laser radiation, Biochemistry (Mosc) 69 (2004) 81-90.
[21] G.G. Borisenko, A.N. Osipov, K.D. Kazarinov and A. Vladimirov Yu, Photochemical reactions of nitrosyl hemoglobin during exposure to low-power laser irradiation, Biochemistry (Mosc) 62 (1997) 661-6.
[22] B. Beltran, A. Mathur, M.R. Duchen, J.D. Erusalimsky and S. Moncada, The effect of nitric oxide on cell respiration: A key to understanding its role in cell survival or death, Proc Natl Acad Sci U S A 97 (2000) 14602-7.
[23] G.C. Brown, Regulation of mitochondrial respiration by nitric oxide inhibition of cytochrome c oxidase, Biochim Biophys Acta 1504 (2001) 46-57.
[24] N. Lane, Cell biology: power games, Nature 443 (2006) 901-3.
[25] G.C. Brown and V. Borutaite, Nitric oxide inhibition of mitochondrial respiration and its role in cell death, Free Radic Biol Med 33 (2002) 1440-50.
[26] P. Ghafourifar and E. Cadenas, Mitochondrial nitric oxide synthase, Trends Pharmacol Sci 26 (2005) 190-5.
[27] E. Clementi, G.C. Brown, N. Foxwell and S. Moncada, On the mechanism by which vascular endothelial cells regulate their oxygen consumption, Proc Natl Acad Sci U S A 96 (1999) 1559-62.
[28] F. Antunes, A. Boveris and E. Cadenas, On the mechanism and biology of cytochrome oxidase inhibition by nitric oxide, Proc Natl Acad Sci U S A 101 (2004) 16774-9.
[29] T.I. Karu, L.V. Pyatibrat and N.I. Afanasyeva, Cellular effects of low power laser therapy can be mediated by nitric oxide, Lasers Surg Med 36 (2005) 307-14.
[30] V. Borutaite, A. Budriunaite and G.C. Brown, Reversal of nitric oxide-, peroxynitrite- and S-nitrosothiol-induced inhibition of mitochondrial respiration or complex I activity by light and thiols, Biochim Biophys Acta 1459 (2000) 405-12.
[31] G.A. Guzzardella, M. Fini, P. Torricelli, G. Giavaresi and R. Giardino, Laser stimulation on bone defect healing: an in vitro study, Lasers Med Sci 17 (2002) 216-20.
[32] H. Tuby, L. Maltz and U. Oron, Modulations of VEGF and iNOS in the rat heart by low level laser therapy are associated with cardioprotection and enhanced angiogenesis, Lasers Surg Med 38 (2006) 682-8.
[33] Y. Moriyama, E.H. Moriyama, K. Blackmore, M.K. Akens and L. Lilge, In vivo study of the inflammatory modulating effects of low-level laser therapy on iNOS expression using bioluminescence imaging, Photochem Photobiol 81 (2005) 1351-5.
[34] M.C. Leung, S.C. Lo, F.K. Siu and K.F. So, Treatment of experimentally induced transient cerebral ischemia with low energy laser inhibits nitric oxide synthase activity and up-regulates the expression of transforming growth factor-beta 1, Lasers Surg Med 31 (2002) 283-8.
[35] H. Friedmann, R. Lubart, I. Laulicht and S. Rochkind, A possible explanation of laser-induced stimulation and damage of cell cultures, J Photochem Photobiol B 11 (1991) 87-91.
[36] M. Eichler, R. Lavi, A. Shainberg and R. Lubart, Flavins are source of visible-light-induced free radical formation in cells, Lasers Surg Med 37 (2005) 314-9.
[37] K. Plaetzer, T. Kiesslich, B. Krammer and P. Hammerl, Characterization of the cell death modes and the associated changes in cellular energy supply in response to AlPcS4-PDT, Photochem Photobiol Sci 1 (2002) 172-7.
[38] R. Lubart, M. Eichler, R. Lavi, H. Friedman and A. Shainberg, Low-energy laser irradiation promotes cellular redox activity, Photomed Laser Surg 23 (2005) 3-9.
[39] R. Duan, T.C. Liu, Y. Li, H. Guo and L.B. Yao, Signal transduction pathways involved in low intensity He-Ne laser-induced respiratory burst in bovine neutrophils: a potential mechanism of low intensity laser biostimulation, Lasers Surg Med 29 (2001) 174-8.
[40] F.Q. Schafer and G.R. Buettner, Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple, Free Radic Biol Med 30 (2001) 1191-212.
[41] H. Liu, R. Colavitti, Rovira, II and T. Finkel, Redox-dependent transcriptional regulation, Circ Res 97 (2005) 967-74.
[42] M. Yang, N.B. Nazhat, X. Jiang, S.M. Kelsey, D.R. Blake, A.C. Newland and C.J. Morris, Adriamycin stimulates proliferation of human lymphoblastic leukaemic cells via a mechanism of hydrogen peroxide (H2O2) production, Br J Haematol 95 (1996) 339-44.
[43] W.G. Kirlin, J. Cai, S.A. Thompson, D. Diaz, T.J. Kavanagh and D.P. Jones, Glutathione redox potential in response to differentiation and enzyme inducers, Free Radic Biol Med 27 (1999) 1208-18.
[44] S. Alaluf, H. Muir-Howie, H.L. Hu, A. Evans and M.R. Green, Atmospheric oxygen accelerates the induction of a post-mitotic phenotype in human dermal fibroblasts: the key protective role of glutathione, Differentiation 66 (2000) 147-55.
[45] T. Karu, Primary and secondary mechanisms of action of visible to near-IR radiation on cells, J Photochem Photobiol B 49 (1999) 1-17.
[46] O. Tiphlova and T. Karu, Action of low-intensity laser radiation on Escherichia coli, Crit Rev Biomed Eng 18 (1991) 387-412.
[47] T.I. Karu, L.V. Pyatibrat, G.S. Kalendo and R.O. Esenaliev, Effects of monochromatic low-intensity light and laser irradiation on adhesion of HeLa cells in vitro, Lasers Surg Med 18 (1996) 171-7.
[48] P. Moore, T.D. Ridgway, R.G. Higbee, E.W. Howard and M.D. Lucroy, Effect of wavelength on low-intensity laser irradiation-stimulated cell proliferation in vitro, Lasers Surg Med 36 (2005) 8-12.
[49] D. Hawkins and H. Abrahamse, Biological effects of helium-neon laser irradiation on normal and wounded human skin fibroblasts, Photomed Laser Surg 23 (2005) 251-9.
[50] H.S. Yu, C.S. Wu, C.L. Yu, Y.H. Kao and M.H. Chiou, Helium-neon laser irradiation stimulates migration and proliferation in melanocytes and induces repigmentation in segmental-type vitiligo, J Invest Dermatol 120 (2003) 56-64.
[51] S. Young, P. Bolton, M. Dyson, W. Harvey and C. Diamantopoulos, Macrophage responsiveness to light therapy, Lasers Surg Med 9 (1989) 497-505.
[52] Y. Fujimaki, T. Shimoyama, Q. Liu, T. Umeda, S. Nakaji and K. Sugawara, Low-level laser irradiation attenuates production of reactive oxygen species by human neutrophils, J Clin Laser Med Surg 21 (2003) 165-70.
[53] Y.S. Chen, S.F. Hsu, C.W. Chiu, J.G. Lin, C.T. Chen and C.H. Yao, Effect of low-power pulsed laser on peripheral nerve regeneration in rats, Microsurgery 25 (2005) 83-9.
[54] M. Miloro, L.E. Halkias, S. Mallery, S. Travers and R.G. Rashid, Low-level laser effect on neural regeneration in Gore-Tex tubes, Oral Surg Oral Med Oral Pathol Oral Radiol Endod 93 (2002) 27-34.
[55] P. Balaban, R. Esenaliev, T. Karu, E. Kutomkina, V. Letokhov, A. Oraevsky and N. Ovcharenko, He-Ne laser irradiation of single identified neurons, Lasers Surg Med 12 (1992) 329-37.
[56] K.R. Byrnes, R.W. Waynant, I.K. Ilev, X. Wu, L. Barna, K. Smith, R. Heckert, H. Gerst and J.J. Anders, Light promotes regeneration and functional recovery and alters the immune response after spinal cord injury, Lasers Surg Med 36 (2005) 171-85.
[57] S.O. el Sayed and M. Dyson, Effect of laser pulse repetition rate and pulse duration on mast cell number and degranulation, Lasers Surg Med 19 (1996) 433-7.
[58] R.A. Lopes-Martins, R. Albertini, P.S. Martins, J.M. Bjordal and H.C. Faria Neto, Spontaneous effects of low-level laser therapy (650 nm) in acute inflammatory mouse pleurisy induced by Carrageenan, Photomed Laser Surg 23 (2005) 377-81.
[59] A.D. Agaiby, L.R. Ghali, R. Wilson and M. Dyson, Laser modulation of angiogenic factor production by T-lymphocytes, Lasers Surg Med 26 (2000) 357-63.
[60] S. Passarella, E. Casamassima, S. Molinari, D. Pastore, E. Quagliariello, I.M. Catalano and A. Cingolani, Increase of proton electrochemical potential and ATP synthesis in rat liver mitochondria irradiated in vitro by helium-neon laser, FEBS Lett 175 (1984) 95-9.
[61] M. Greco, G. Guida, E. Perlino, E. Marra and E. Quagliariello, Increase in RNA and protein synthesis by mitochondria irradiated with helium-neon laser, Biochem Biophys Res Commun 163 (1989) 1428-34.
[62] D. Pastore, M. Greco, V.A. Petragallo and S. Passarella, Increase in H+/e- ratio of the cytochrome c oxidase reaction in mitochondria irradiated with helium-neon laser, Biochem Mol Biol Int 34 (1994) 817-26.
[63] Y. Zhang, S. Song, C.C. Fong, C.H. Tsang, Z. Yang and M. Yang, cDNA microarray analysis of gene expression profiles in human fibroblast cells irradiated with red light, J Invest Dermatol 120 (2003) 849-57.
[64] R.F. Lyons, R.P. Abergel, R.A. White, R.M. Dwyer, J.C. Castel and J. Uitto, Biostimulation of wound healing in vivo by a helium-neon laser, Ann Plast Surg 18 (1987) 47-50.
[65] H.S. Yu, K.L. Chang, C.L. Yu, J.W. Chen and G.S. Chen, Low-energy helium-neon laser irradiation stimulates interleukin-1 alpha and interleukin-8 release from cultured human keratinocytes, J Invest Dermatol 107 (1996) 593-6.
[66] V.K. Poon, L. Huang and A. Burd, Biostimulation of dermal fibroblast by sublethal Q-switched Nd:YAG 532 nm laser: collagen remodeling and pigmentation, J Photochem Photobiol B 81 (2005) 1-8.
[67] N. Kipshidze, V. Nikolaychik, M.H. Keelan, L.R. Shankar, A. Khanna, R. Kornowski, M. Leon and J. Moses, Low-power helium: neon laser irradiation enhances production of vascular endothelial growth factor and promotes growth of endothelial cells in vitro, Lasers Surg Med 28 (2001) 355-64.
[68] A. Khanna, L.R. Shankar, M.H. Keelan, R. Kornowski, M. Leon, J. Moses and N. Kipshidze, Augmentation of the expression of proangiogenic genes in cardiomyocytes with low dose laser irradiation in vitro, Cardiovasc Radiat Med 1 (1999) 265-9.
[69] A.R. Medrado, L.S. Pugliese, S.R. Reis and Z.A. Andrade, Influence of low level laser therapy on wound healing and its biological action upon myofibroblasts, Lasers Surg Med 32 (2003) 239-44.
[70] E.J. Neiburger, Rapid healing of gingival incisions by the helium-neon diode laser, J Mass Dent Soc 48 (1999) 8-13, 40.
[71] J.T. Eells, M.M. Henry, P. Summerfelt, M.T. Wong-Riley, E.V. Buchmann, M. Kane, N.T. Whelan and H.T. Whelan, Therapeutic photobiomodulation for methanol-induced retinal toxicity, Proc Natl Acad Sci U S A 100 (2003) 3439-44.
[72] M.T. Wong-Riley, H.L. Liang, J.T. Eells, B. Chance, M.M. Henry, E. Buchmann, M. Kane and H.T. Whelan, Photobiomodulation directly benefits primary neurons functionally inactivated by toxins: role of cytochrome c oxidase, J Biol Chem 280 (2005) 4761-71.
[73] D. Gigo-Benato, S. Geuna and S. Rochkind, Phototherapy for enhancing peripheral nerve repair: a review of the literature, Muscle Nerve 31 (2005) 694-701.
[74] J.J. Anders, S. Geuna and S. Rochkind, Phototherapy promotes regeneration and functional recovery of injured peripheral nerve, Neurol Res 26 (2004) 233-9.
[75] J.J. Anders, R.C. Borke, S.K. Woolery and W.P. Van de Merwe, Low power laser irradiation alters the rate of regeneration of the rat facial nerve, Lasers Surg Med 13 (1993) 72-82.
[76] K. Branco and M.A. Naeser, Carpal tunnel syndrome: clinical outcome after low-level laser acupuncture, microamps transcutaneous electrical nerve stimulation, and other alternative therapies--an open protocol study, J Altern Complement Med 5 (1999) 5-26.
[77] J. Irvine, S.L. Chong, N. Amirjani and K.M. Chan, Double-blind randomized controlled trial of low-level laser therapy in carpal tunnel syndrome, Muscle Nerve 30 (2004) 182-7.
[78] M.I. Weintraub, Noninvasive laser neurolysis in carpal tunnel syndrome, Muscle Nerve 20 (1997) 1029-31.
[79] Y. Ueda and N. Shimizu, Pulse irradiation of low-power laser stimulates bone nodule formation, J Oral Sci 43 (2001) 55-60.
[80] Y. Ueda and N. Shimizu, Effects of pulse frequency of low-level laser therapy (LLLT) on bone nodule formation in rat calvarial cells, J Clin Laser Med Surg 21 (2003) 271-7.
[81] M.S. Ribeiro, F. Da Silva Dde, C.E. De Araujo, S.F. De Oliveira, C.M. Pelegrini, T.M. Zorn and D.M. Zezell, Effects of low-intensity polarized visible laser radiation on skin burns: a light microscopy study, J Clin Laser Med Surg 22 (2004) 59-66.
[82] T. Moshkovska and J. Mayberry, It is time to test low level laser therapy in Great Britain, Postgrad Med J 81 (2005) 436-41.
[83] L.A. Santana-Blank, E. Rodriguez-Santana and K.E. Santana-Rodriguez, Photo-infrared pulsed bio-modulation (PIPBM): a novel mechanism for the enhancement of physiologically reparative responses, Photomed Laser Surg 23 (2005) 416-24.
[84] M.L. Kripke, Ultraviolet radiation and immunology: something new under the sun--presidential address, Cancer Res 54 (1994) 6102-5.
[85] P. Whittaker, Laser acupuncture: past, present, and future, Lasers Med Sci 19 (2004) 69-80.
8/14/08